Le design des récifs artificiels influence le devenir écologique des récifs restaurés

L’équipe d’Ewout Knoester a montré, au Kénya, que le type de structure de récif artificiel utilisée pour la restauration corallienne impacte la survie des coraux et leur diversité mais également la diversité des poissons et des autres espèces animales de l’écosystème corallien. L’utilisation conjointe de cages métalliques et de couches de béton semble être le design le plus optimal.
La couverture des récifs coralliens dans le monde ne cesse de baisser (Eddy et al., 2021), notamment à cause des épisodes de blanchissement massifs (Ainsworth and Brown, 2021). D’autres causes plus locales existent, comme la surpêche (Mumby and Harborne, 2010), les activités nautiques (Dinsdale and Harriott, 2004 ; Flynn and Forrester, 2019), l’augmentation de la prédation par les étoiles de mer Acanthaster spp. (Kayal et al., 2012), … Les causes de la mortalité des récifs coralliens sont d’ailleurs le plus souvent multifactorielles (Sale, 2008). Avant tout effort de restauration corallienne, il est important de comprendre la ou les cause(s) de la mortalité du récif et de les contrer autant que possible, puis de protéger le zone du récif en cours de restauration (Hughes et al., 2007; Mumby and Harborne, 2010). Une fois cela fait, il y a plusieurs choix à faire sur les méthodes de restauration à mettre en place, et l’utilisation de récif artificiel comme support de substrat est une option répandue. Mais peu d’études comparent différentes structures de récifs artificiels, et c’est ce qu’on fait sur deux ans Ewout Knoester et son équipe (Knoester et al., 2023).
Récifs artificiels testés
Les récifs artificiels ont été placés au Kenya, dans les eaux du village de Mkwiro (figure 1A). En plus d’une zone de contrôle sans coraux (figure 1B), et d’une zone référence avec un récif non restauré (figure 1C), Knoester et al. (2023) ont testé plusieurs récifs artificiels :
– 16 modules constitués chacun de 8 bouteilles de verre fixées sur un disque en béton (figure 1D),
– 4 cages métalliques (figure 1E),
– 8 empilements de 4 disques de béton séparés par des tubes PVC (figure 1F),
– un mix de 4 modules de bouteilles de verre, 1 cage et 2 empilements de béton (figure 1G).
Chaque récif artificiel a été reproduit 10 fois, donnant un total de 40 récifs artificiels testés, avec également 10 points de contrôle et 10 points de référence.
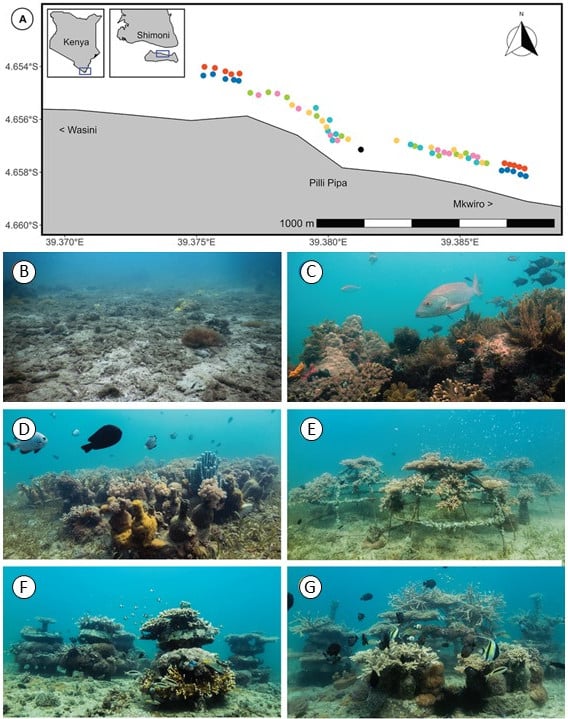
Figure 1 : Carte de la zone d’étude au Kenya (A) et photos au début de l’expérimentation de la zone contrôle sans récif (B), de la zone récifale référence (C), du récif artificiel composé de bouteilles de verre (D), du récif artificiel composé de cages (E), du récif artificiel composé de disques de béton (F) et du récif artificiel mix (G).
Résultats
Si la couverture en coraux durs des récifs artificiels est similaire à celle des récifs références, sauf pour les récifs de bouteilles, la diversité corallienne est par contre bien plus faible dans les récifs artificiels (Figure 2), avec une très forte dominance des coraux Acropora spp., des coraux branchus à croissance rapide. La survie des coraux était de 60% au bout de deux ans, avec une variabilité dans les causes de mortalité liée au type de récifs. Le taux de survie était meilleur dans les cages métalliques, car il n’y a pas de prédation par les étoiles de mer Acanthaster spp. ou de casse par les tortures se frottant aux coraux. A l’inverse, les récifs de bouteilles présentent une plus forte mortalité pour ces raisons.
Si les coraux ont un meilleur taux de survie sur les cages, à l’inverse le recrutement y est beaucoup plus faible que sur les bouteilles ou les empilements de béton. Le recrutement reste toujours meilleur, en termes de nombre et de diversité, sur les récifs références. Le peu de surface disponible sur les cages explique cette différence. Il semble également que le béton soit une surface permettant la fixation de larves de coraux.
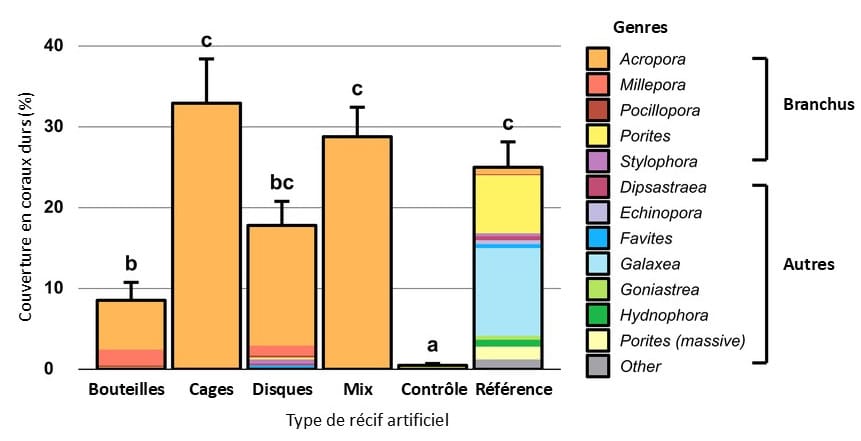
Figure 2 : Pourcentage de couverture en coraux durs (incluant les hydrozoaires Millepora) après deux ans de restauration corallienne. La barre d’erreur correspond au SE (n = 10). Les traitements présentant les mêmes lettres ne présentent pas de différences significatives (p<0.05). Les couleurs représentent les genres de coraux, répartis entre les coraux branchus et les autres formes de coraux.
En termes de diversité écologique et fonctionnelle, les récifs références sont toujours plus divers que les récifs artificiels, mais ceux-ci présentent des résultats intéressants et non négligeables. Les poissons sont aussi nombreux en termes de biomasse et d’abondance dans les récifs artificiels ou référents, avec une diversité d’espèces plus importante dans les récifs restaurés. Il n’y a pas de différences entre les récifs artificiels concernant les communautés de poissons, la couverture en coraux durs semblant être plus déterminante que le type de récifs artificiels. De plus, tous les niveaux trophiques sont retrouvés : la diversité fonctionnelle, nécessaire pour le bon fonctionnement écologique d’un récif, est donc présente dans chaque récif artificiel.
Par contre, la diversité en invertébrés dépend des groupes considérés, mais elle est toujours plus importante dans les récifs contrôlés. De grandes disparités existent entre récifs artificiels : les cages présentent peu d’invertébrés en dehors des gastéropodes, à l’inverse des bouteilles et empilements de disques qui attirent plus d’invertébrés, sans jamais atteindre la diversité des récifs références.
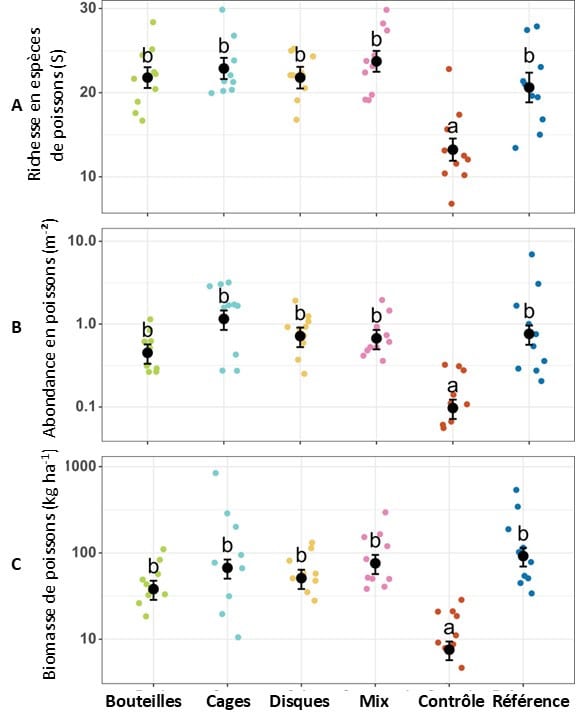
Figure 3 : A – Richesse en espèces de poissons, B – Abondance en poissons et C – Biomasse de poissons après deux ans de restauration corallienne. La barre d’erreur correspond au SE (n = 10). Les traitements présentant les mêmes lettres ne présentent pas de différences significatives (p<0.05). Les points colorés correspondent aux différents réplicats pour chaque traitement.
Conclusion
Même si cette étude, conduite sur 2 ans, est un peu courte en durée pour avoir une vision long terme de l’évolution des récifs restaurés, elle donne néanmoins des pistes très intéressantes. En plus du choix du lieu d’implantation (Edwards and Clark, 1999), de la technique de bouturage, avec nurserie ou non (Boström-Einarsson et al., 2020), le choix du récif artificiel impacte la récupération écologique des récifs. Il semblerait qu’un mix entre cages métalliques et empilement de blocs de béton permette un bon compromis entre les avantages et les inconvénients de chaque. Si l’utilisation de bouteilles de verre ne semble pas être la meilleure solution pour restaurer le récif, cela peut permettre de créer un repaire pour les tortues, qui peuvent notamment s’y frotter.
Références
Ainsworth, T.D., Brown, B.E., 2021. Coral bleaching. Curr. Biol. 31, R5–R6. https://doi.org/10.1016/j.cub.2020.10.048
Boström-Einarsson, L., Babcock, R.C., Bayraktarov, E., Ceccarelli, D., Cook, N., Ferse, S.C.A., Hancock, B., Harrison, P., Hein, M., Shaver, E., Smith, A., Suggett, D., Stewart-Sinclair, P.J., Vardi, T., McLeod, I.M., 2020. Coral restoration – A systematic review of current methods, successes, failures and future directions. PLOS ONE 15, e0226631. https://doi.org/10.1371/journal.pone.0226631
Cisneros-Montemayor, A.M., Greer, K., Palomares, M.L.D., Bruno, J.F., Ota, Y., Cheung, W.W.L., 2021. Global decline in capacity of coral reefs to provide ecosystem services. One Earth 4, 1278–1285. https://doi.org/10.1016/j.oneear.2021.08.016
Dinsdale, E.A., Harriott, V.J., 2004. Assessing Anchor Damage on Coral Reefs: A Case Study in Selection of Environmental Indicators. Environ. Manage. 33, 126–139. https://doi.org/10.1007/s00267-003-3056-9
Edwards, A.J., Clark, S., 1999. Coral transplantation: A useful management tool or misguided meddling? Mar. Pollut. Bull. 37, 474–487. https://doi.org/10.1016/S0025-326X(99)00145-9
Flynn, R.L., Forrester, G.E., 2019. Boat anchoring contributes substantially to coral reef degradation in the British Virgin Islands. PeerJ 7, e7010. https://doi.org/10.7717/peerj.7010
Hughes, T.P., Bellwood, D.R., Folke, C.S., McCook, L.J., Pandolfi, J.M., 2007. No-take areas, herbivory and coral reef resilience. Trends Ecol. Evol. 22, 1–3. https://doi.org/10.1016/j.tree.2006.10.009
Kayal, M., Vercelloni, J., Loma, T.L. de, Bosserelle, P., Chancerelle, Y., Geoffroy, S., Stievenart, C., Michonneau, F., Penin, L., Planes, S., Adjeroud, M., 2012. Predator Crown-of-Thorns starfish (Acanthaster planci) outbreak, mass mortality of corals, and cascading effects on reef fish and benthic communities. PLOS ONE 7, e47363. https://doi.org/10.1371/journal.pone.0047363
Knoester, E.G., Rienstra, J.J., Schürmann, Q.J.F., Wolma, A.E., Murk, A.J., Osinga, R. 2023. Community-managed coral reef restoration in southern Kenya initiates reef recovery using various artificial reef designs. Front. Mar. Sci. 10:1152106. https://doi.org/10.3389/fmars.2023.1152106
Mumby, P.J., Harborne, A.R., 2010. Marine reserves enhance the recovery of corals on Caribbean reefs. PLOS ONE 5, e8657. https://doi.org/10.1371/journal.pone.0008657
Sale, P.F., 2008. Management of coral reefs: Where we have gone wrong and what we can do about it. Mar. Pollut. Bull. 56, 805–809. https://doi.org/10.1016/j.marpolbul.2008.04.009
Ces articles pourraient vous intéresser

APPEL À PROJETS
APPEL À PROJETS Pour le développement d’un programme de conservation de récifs en partenariat avec Coral Guardian. CONTEXTE L’association Coral Guardian Coral Guardian…
15 January 2025
Humble Bundle soutient nos efforts de restauration pendant le Mois de la Terre !
Le soutien de Humble Bundle pendant le Mois de la Terre permet de soutenir les efforts de restauration de Coral Guardian. Humble Bundle, un magasin…
30 September 2024
Les 10 règles d’or de la restauration corallienne
Remerciements à Margaux Hein, Kate M. Quigley et à David J. Suggett. La restauration corallienne est de plus en plus répandue, un peu partout dans…
1 August 2024
Avec Lilo soutenez-nous gratuitement !
Les coraux abritent 25% de toute la biodiversité marine dans le monde, et plus d’un milliard de personnes en dépendent directement pour vivre ! Cependant,…
3 July 2023
